Introduction
Les êtres vivants sont très divers au sein d’une même espèce. Ils partagent certains caractères qu’ils héritent de leurs parents, mais ne se ressemblent pas : leur phénotype est différent car leur génotype est différent.Quels sont les mécanismes cellulaires qui permettent la diversité génétique des êtres vivants au sein d’une même espèce ?On étudiera les effets des mutations, puis les brassages au cours de la reproduction sexuée, et enfin les anomalies de méiose.
I. La conservation des génomes : stabilité génétique et évolution clonale
TP1A1
A. Stabilité génétique
Rappels 1eSVT : Les cellules se divisent par mitose pour les cellules somatiques, ou méiose pour les cellules germinales. Ces clones sont constitués de cellules isolées (ex : cellules sanguines, bactéries) ou associées de façon stable par la matrice extracellulaire pour les tissus solides. Ainsi, une cellule qui subit une succession de mitoses donne naissance à un ensemble de cellules toutes génétiquement identiques(sans tenir compte des mutations) appelé clone cellulaire : c’est l’origine de la stabilité génétique.
Elle est à l’origine de la croissance d’un organisme par multiplication cellulaire, du renouvellement cellulaire avec le remplacement des cellules lésées ou âgées, de sa reproduction asexuée (ex : obtention de cals ou de boutures chez les plantes).
B. Evolution clonale
Néanmoins, des accidents génétiques peuvent survenir au sein d’une cellule d’un clone. Tout accident génétique irréversible devient pérenne pour toute la lignée cellulaire qui dérive de la cellule modifiée. L’ensemble des cellules-filles issues de la division d’une même cellule-mère et qui hérite de cet accident génétique forme ainsi un sous-clone génétiquement légèrement différent du reste de l’organisme. Ces accidents génétiques peuvent être :
- des mutations :au cours des divisions cellulaires, l’ADN est répliqué de façon semi-conservative, mais des mutations peuvent avoir lieu pendant la réplication ou non. Si le système de réparation des mutations ne la corrige pas, la mutation se transmet aux cellules-filles, formant des clones cellulaires.Ainsi, on observe dans l’organisme des sous-clones de cellules portant une même mutation (ex 1 : toutes les cellules cancéreuses sont issues de la division d’une cellule portant des mutations des gènes du contrôle du cycle cellulaire et héritent de cette mutation et forment un sous-clone ; ex 2 :les bactéries résistantes à un antibiotique héritent toutes de la mutation d’une cellule ayant acquis un allèle résistant à un antibiotique).
- la perte ou la duplication d’un gène : par exemple, les lymphocytes subissent au cours de leur maturation une recombinaison génétique qui leur fait porter une combinaison unique de gènes V, D, J. Toutes les cellules issues de la division d’un lymphocyte B naïf lors de l’amplification clonale porteront cette combinaison et formeront un clone de cellules génétiquement identiques. (voir aussi les familles multigéniques : cf.IV.B de ce chapitre).
- une séparation anormale des chromosomes : par exemple dans des cellules cancéreuses, ou à l’origine d’une anomalie du nombre de chromosomes de l’enfant si cette séparation anormale a lieu dans les cellules germinales (ex : Trisomie 21, cf. IV.B de ce chapitre).
L’organisme héberge ainsi divers sous-clones de cellules qui diffèrent entre elles par des accidents génétiques, ou une combinaison particulière de gènes (ex : gènes VDJ des lymphocytes B). Il existe ainsi une diversité génétique entre les sous-clones cellulaires d’un même organisme.
Ces mutations peuvent avoir des conséquences sur le phénotype. Plus elles ont eu lieu tôt dans le développement (mutation précoce), plus le nombre de cellules mutées sera grand et plus le secteur mutant constitué de sous-clones aura une place importante dans l’organisme. Les mutations « de novo » de maladies génétiques qui apparaissent dans une famille où la maladie n’était pas présente supposent que la mutation s’est produite à un stade très précoce de la cellule-œuf, ou dans les cellules germinales d’un des parents. Les mutations ayant pour conséquence une division cellulaire incontrôlée et anarchique peuvent mener à des lignées de sous-clones qui se reproduisent intensivement et colonisent l’organisme au dépend des cellules saines : c’est ainsi que se forment les cancers.Ex séquence régulatrice du gène.
Enfin, des mutations touchant les cellules germinales (cellules des ovaires ou des testicules et qui seront à l’origine des gamètes) pourront être transmises à la descendance de l’individu. L’information génétique mutée, transmise lors de la fécondation, sera présente dans la cellule-œuf puis dans toutes les cellules de l’organisme du nouvel individu.
Les accidents génétiques sont donc à l’origine de l’évolution clonale d’un individu : un individu est une mosaïque de sous-clones de cellules génétiquement différents, qui évoluent au cours de la vie de façon indépendante pour former éventuellement de nouveaux sous-clones.
II. Le brassage des génomes à chaque génération : la reproduction sexuée des eucaryotes
Le brassage génétique correspond au mélange et à la ségrégation (séparation) des chromosomes et des gènes qu’ils portent entre les gamètes, ce qui de nouvelles associations de gènes dans les cellules. Il a lieu au cours des 2 divisions méiotiques ainsi que de la fécondation.
A. Le brassage génétique au cours de la méiose
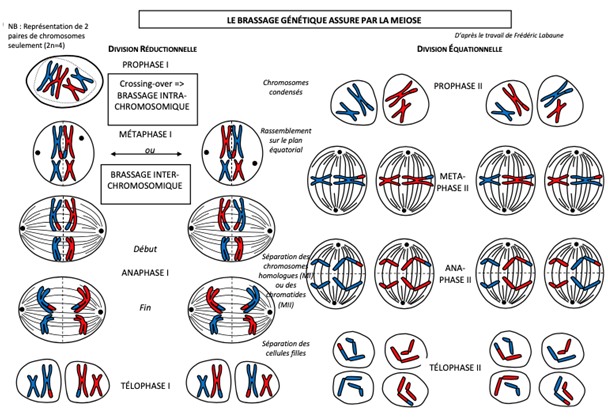
- Le brassage intrachromosomique au cours de la prophase I :
Pendant la prophase I, les chromosomes se condensent et deviennent visibles.Les chromosomes homologues (de la même paire) s’apparient au niveau de leur centromère et les chromatides s’accolent entre elles sur toute leur longueur, formant des bivalents (= 2 chromosomes associés) ou tétrades (4 chromatides). Parfois, les chromatides d’une paire de chromosomes homologues se croisent entre elles en différents points visibles en microscopie appelés chiasma. Ce sont des sites de recombinaison génétique = crossing-over ou enjambement : les chromatides des 2 chromosomes sont coupées au niveau des chiasmas et assemblées avec la chromatide de l’autre chromosome.Les chromosomes homologues ont ainsi échangé des fragments de chromatides, et chaque chromatide d’un chromosome porte donc certains allèles de l’autre chromosome homologue : il y a eu brassage des gènes à l’intérieur de chaque chromosome, c’est le brassage intrachromosomique. Il concerne uniquement les gènes liés, c’est-à-dire des gènes différents portés par un même chromosome. Les crossing-over n’ont pas d’effet sur les gènes homozygotes. Pour un couple de gènes hétérozygotes, les chromosomes recombinés ne portent plus les mêmes combinaisons d’allèles. Les crossing-over entre 2 gènes liés restent un phénomène rare, ce qui explique que les gamètes recombinés sont moins fréquents que les gamètes parentaux.
- Le brassage interchromosomique lors de l’anaphase I de la 1edivision de méiose :
La 1e division de méiose se poursuit avec la séparation des chromosomes homologues pendant l’anaphase I, qui sépare I les chromosomes homologues entre les 2 cellules-filles : elle aboutit ainsi à 2 cellules filles haploïdes génétiquement différentes, avec chacune une combinaison unique de n chromosomes à 2 chromatides : c’est le brassage interchromosomique, qui se produit pour des gènes indépendants portés par des chromosomes différents. Les chromosomes se répartissent au hasard entre les cellules filles, formant des gamètes équiprobables.
La 2e division de méiose sépare les chromatides de chaque chromosome homologue entre les deux cellules filles.Une cellule-mère forme donc 4 cellules-filles haploïdes (n) avec chacune n chromosomes à une chromatide, ou gamètes.
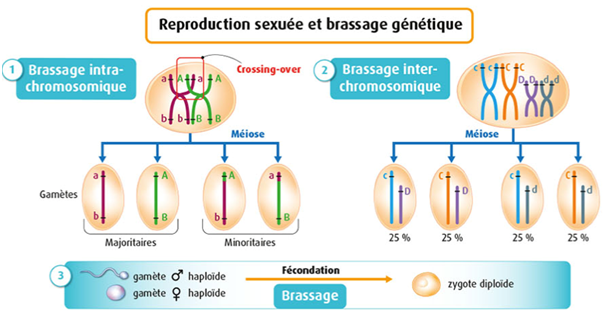
B. Le brassage génétique au cours de la fécondation
Au cours de la fécondation, un gamète mâle et un gamète femelle haploïdes (n) comportant chacun un lot = jeu de chromosomes et donc un lot d’allèles, fusionnent pour former une cellule-œuf (=zygote) diploïde (2n) avec 2 jeux de chromosomes et donc 2 allèles pour chaque gène, l’un provenant du père, l’autre de la mère, qui sont identiques (homozygotie) ou différents (hétérozygotie).
La rencontre des gamètes au cours de la fécondation est aléatoire. Elle reconstitue les couples d’allèles de façon aléatoire, et produit un brassage interchromosomique en formant de nouvelles combinaisons génétiques. Le nombre de combinaisons génétiques possibles dans les gamètes est d’autant plus élevé que le nombre de gènes à l’état hétérozygote est plus grand chez les parents. La diversité génétique potentielle des zygotes est immense. Chaque zygote contient donc une combinaison unique et nouvelle d’allèles.
Sans tenir compte du brassage intrachromosomique, la fécondation produit 223 * 223 = 70 000 milliards de cellules-œufs différentes pour l’espèce humaine.
III. Comprendre les résultats de la reproduction sexuée : principes de base de la génétique
A. L’analyse génétique des croisements
1. Les lois de Mendel et les « particules héréditaires »
TP1A2 Mendel
L’analyse génétique peut se fonder sur l’étude de la transmission héréditaire des caractères observables (phénotype), dans des croisements issus le plus souvent de lignées pures (homozygotes) et ne différant que par un nombre limité de caractères. Ainsi,Gregor Mendel, botaniste et généticien, réalisa de nombreuses expériences de croisements avec des lignées pures (organismes homozygotes) chez le pois afin d’étudier l’hérédité, en ne portant à chaque fois son étude que sur un nombre limité de caractères. Il fit 3 observations :
– les hybrides F1, provenant du croisement de deux lignées pures (homozygotes), étaient toujours homogènes avec une seule forme du caractère de l’une des lignées (loi n°1 d’uniformité des hybrides) ; ex : pois Lisses x pois ridés ® F1 : pois Lisses
– les caractères des parents de lignée pure réapparaissaient dans la génération F2 issue de l’autofécondation des plants F1 (loi n°2 de disjonction des allèles) : un « facteur » (allèle) s’est transmis et l’un des caractères était « masqué » (récessif) en F1 par l’autre caractère (dominant). Ex : F1 pois Lisse x F1 pois Lisse ® ¾ pois Lisses + ¼ pois ridés
– un couple de caractères (ex : ridé/lisse et jaune/vert) se séparaient en F2, formant des phénotypes parentaux (identiques aux parents) et recombinés (avec un mélange des caractères parentaux) : les deux formes de chaque caractère sont chacune déterminée par allèle qui se sépare de façon indépendante pendant la méiose et la fécondation (loi n°3 de d’indépendance de la transmission des caractères). Ex : P1 pois Lisse Jaune x P2 pois ridé vert –> F1 Lisses Jaunes x F1 –> F2 (9/16 pois lisse jaune + 1/16 ridé vert = phénotypes parentaux) + (3/16 lisse vert + 3/16 ridé jaune = phénotypes recombinés).
Il expliqua ces résultats par l’existence de « particules héréditaires » transmissibles, présentes en deux exemplaires chez les parents mais en un seul exemplaire chez les gamètes. Chaque gamète ne transmet qu’une particule héréditaire du parent, et les gamètes s’associent au hasard lors de la fécondation. Les connaissances actuelles ont permis d’identifier ces particules héréditaires : les caractères sont codés par les gènes situés sur les chromosomes présents sous différentes versions appelées allèles. Lorsque les cellules sont diploïdes, elles possèdent des paires de chromosomes, et donc deux allèles pour chaque gène. Elles sont hétérozygotes si les 2 allèles sont différents, ou homozygotes si les 2 allèles sont identiques. Les cellules haploïdes comme les gamètes ne possèdent qu’un chromosome et donc un seul allèle pour chaque gène.
2. Les croisements tests
Le brassage au cours de la méiose peut être mis en évidence par un test-cross ou croisement-test ou rétrocroisementau cours duquel on croise un individu hétérozygote avec un individu homozygote récessif pour le gène étudié. L’étude de leur descendance permet d’identifier le génotype des gamètes de l’individu hétérozygote car les phénotypes des descendant correspondent aux génotypes des gamètes de l’hétérozygote.L’étude de la proportion des phénotypes issus des croisements-tests permet aussi de déterminer si les gènes sont liés ou indépendants. En effet, les échiquiers de Punnett, ou tableaux/échiquiers de croisements, permettent de prédire le patrimoine génétique et la proportion de chaque phénotype des descendants lors des croisements. A l’issue d’un test-cross, pour un couple de gènes :
- liés (portés par un même chromosome) : la probabilité d’un crossing-over entre les deux gènes avec brassage intrachromosomique est assez faible et les gamètes recombinés sont peu fréquents : les phénotypes parentaux sont plus fréquents que les phénotypes recombinés. Plus des gènes liés sont proches l’un de l’autre sur leur chromosome, plus la probabilité qu’il se produise un crossing-over entre eux est faible, et plus le nombre de gamètes recombinés sera faible.Plus la proportion de phénotypes recombinés est faible, et plus les locus des gènes sont rapprochés. C’est sur cette base qu’ont été construites les premières cartes génétiques.
- Indépendants (portés par deux chromosomes) : les chromosomes se répartissent au hasard entre les cellules filles : les phénotypes parentaux et les phénotypes recombinés sont donc équiprobables.
Certains caractères héréditaires ne sont pas répartis de manière équiprobable entre les descendants mâles et femelles. Cette hérédité liée au sexe est due à la localisation de gènes sur les régions non homologues des chromosomes sexuels. Pour les drosophiles et pour les humains, les individus femelles portent deux chromosomes X et les mâles portent un chromosome X et portés par un même chromosome Y. Pour un gène situé sur la partie spécifique du chromosome X, les femelles ont donc une paire d’allèles mais les mâles n’ont qu’un seul allèle. Un gène situé sur la partie spécifique du chromosome Y n’est présent que chez les mâles et en un seul exemplaire, souvent le chromosome Y porte majoritairement des gènes liés au sexe.
B. Les analyses génétiques pour la santé humaine
TD1A7
Dans le cas de l’espèce humaine, l’identification des allèles portés par un individu s’appuie d’abord sur une étude de la transmission du caractère étudié au sein de la famille. On peut analyser l’arbre généalogique de la famille en appliquant les principes de transmission héréditaire des caractères, selon la dominance ou de la récessivité de l’allèle responsable du caractère étudié et du type de chromosome qui porte le gène (autosome = chromosome non sexuel ou gonosome = chromosome sexuel). Ainsi, on reconnaît un caractère dominant car il se transmet à chaque génération, alors qu’un caractère récessif peut « apparaître » chez un individu dont aucun des parents n’a ce caractère. De même, un allèle porté par un autosome touchera les hommes et les femmes de manière équiprobable, alors qu’un allèle sur un chromosome sexuel touchera plus fréquemment les hommes. Ainsi, les hommes n’ayant qu’un chromosome X seront systématiquement touchés par une maladie due à un allèle porté par le chromosome X, alors que les femmes qui devront avoir les 2 allèles récessifs seront moins fréquemment atteintes. Une maladie génétique liée au chromosome Y ne touchera que les hommes.
Ex : gène CFTR mucoviscidose / myopathie de Duchenne
Enfin, le développement des techniques de séquençage de l’ADN et les progrès de la bioinformatique donnent directement accès au génotype de chaque individu comme à ceux de ces ascendants et descendants, ce qui permet des diagnostics, des dépistages précoces ou une évaluation du risque de transmettre une maladie génétique. L’utilisation de bases de données informatisées permet d’identifier des associations entre certains gènes mutés et certains phénotypes.
IV. Les accidents génétiques de la méiose
A. Les anomalies de méiose
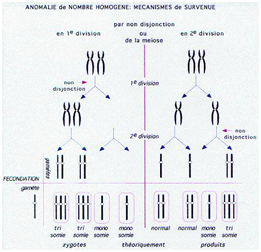
Des anomalies peuvent survenir au cours de la méiose, entrainant une modification du caryotype :
Une migration anormale de chromosomes ou de chromatides produit une cellule présentant un nombre anormal de chromosomes (aneuploïdie) avec une séparation anormale au cours de :
- la méiose I : les chromosomes homologues migrent ensemble dans une seule cellule fille (non-disjonction des chromosomes homologues), l’autre cellule-fille ne recevant pas de chromosome de cette paire ;
- la méiose II :les 2 chromatides d’un même chromosome se séparent au niveau du centromère mais migrent dans la même cellule-fille, formant 2 chromosomes différents.
Dans les 2 cas, une cellule fille reçoit alors 2 chromosomes ou 2 chromatides et l’autre n’en reçoit aucun, ce qui forme 2 ou 4 gamètes anormaux avec :
- 2 chromosomes homologues d’une même paire. Après fécondation, cette cellule présentera une trisomie (3 chromosomes) pour la paire de chromosomes concernée.
- aucun chromosome de cette paire. Après fécondation, cette cellule présentera une monosomie (1 seul chromosome) pour la paire de chromosomes concernée.
Par ailleurs, un crossing-over inégal au cours de la prophase I aboutit parfois à une duplication de gène. Le chromosome porte alors plusieurs copies d’un même gène.
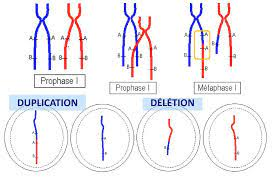
Schéma d’un crossin-over inégal
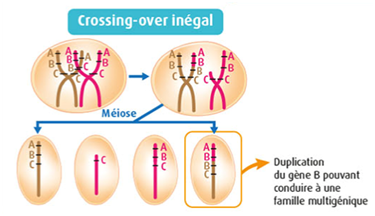
B. Les conséquences des anomalies de méiose
Les anomalies de méiose sont souvent létales, menant à des fausses couches ou avortements spontanés : seules la monosomie X0 (syndrome de Turner) est viable dans l’espèce humaine, et les trisomies T21, XXX, XXY, T18 et T13, les autres mènent systématiquement à des avortements spontanés. Lorsqu’elles sont viables, elles peuvent avoir des répercussions sur le phénotype au niveau physique et/ou mental (ex : syndrome de Down lié à la trisomie 21, syndrome de l’X fragile lié à une duplication d’un segment d’un gène), et sur la fertilité lorsque les chromosomes sexuels (gonosomes) sont en nombre anormal (syndrome de Turner X0). Mais elle aboutit parfois à un isolement reproducteur génétique qui empêche les individus de 2 populations génétiquement trop différentes de se reproduire. Cela aboutit alors à une spéciation.
Ex : souris de Madère, banane sauvage et banane Cavendish.
Cependant, les anomalies de méiose sont aussi sources de diversification des génomes du vivant. Ainsi, elles sont par exemple à l’origine des familles multigéniques : ce sont des ensembles de gènes apparentés codant pour des protéines de structure proche et de fonction généralement proche. Les gènes des familles multigéniques se ressemblent beaucoup, ce qui indique une origine commune, mais ils présentent des différences. Le gène ancestral a été dupliqué ; par la suite, chaque copie a évolué indépendamment par mutations qui s’accumulent au cours du temps, ce qui est à l’origine des différences présentes entre les copies des gènes de familles multigéniques. Cela permet parfois à l’individu d’acquérir de nouvelles fonctions. Ces anomalies de méiose jouent donc un rôle important dans l’enrichissement du génome et dans l’évolution.
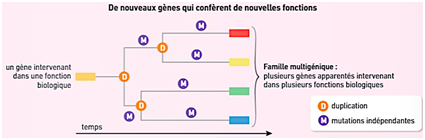
Schéma de formation d’une famille multigénique
Conclusion
La diversité génétique des individus provient :
- des accidents génétiques qui se transmettent au cours des mitoses, formant des mosaïques de clones cellulaires au sein d’un organisme
- des brassages inter et intrachromosomiques qui ont lieu au cours de la méiose, ainsi que du brassage interchromosomique dû à l’appariement au hasard des chromosomes des gamètes au cours de la fécondation.
- Des anomalies de méiose
Tout ceci participe à la diversité des individus. D’autres mécanismes interviennent permettant d’expliquer la diversité des êtres vivants.
Pour aller plus loin: (thématiques associées):
Les organismes comporteraient des cellules issues d’autres organismes, et seraient donc non seulement des mosaïques de clones cellulaires portant diverses mutations, mais en plus une mosaïque de cellules ayant un patrimoine génétique différent car issues de différents organismes. C’est ce qu’on appelle le chimérisme. On en retrouve chez les humains: c’est le mirochimérisme foeto-maternel.
https://www.youtube.com/watch?v=OHSzXFMSwlA
Différents types de mosaïcisme chez le chat : https://www.persee.fr/doc/bavf_0001-4192_2017_num_170_1_1602
