Lorsque l’immunité innée ne suffit pas pour éliminer un pathogène, les CPA (cellules présentatrices d’antigène : macrophages, cellules dendritiques, monocytes) migrent dans les organes lymphoïdes secondaires (rate, ganglions lymphatiques, amygdales) où elles présentent l’antigène (= fragment du pathogène) associé au CMH (Complexe Majeur d’Histocompatibilité) à un lymphocyte T. Cela déclenche l’immunité adaptative. Comment l’immunité adaptative élimine-t-elle le pathogène ? Après avoir abordé les caractéristiques de cette immunité, nous expliquerons sa spécificité, puis l’élimination du pathogène, et enfin les bases de la mémoire immunitaire.
I. Les Caractéristiques de l’immunité adaptative
A) Une apparition récente
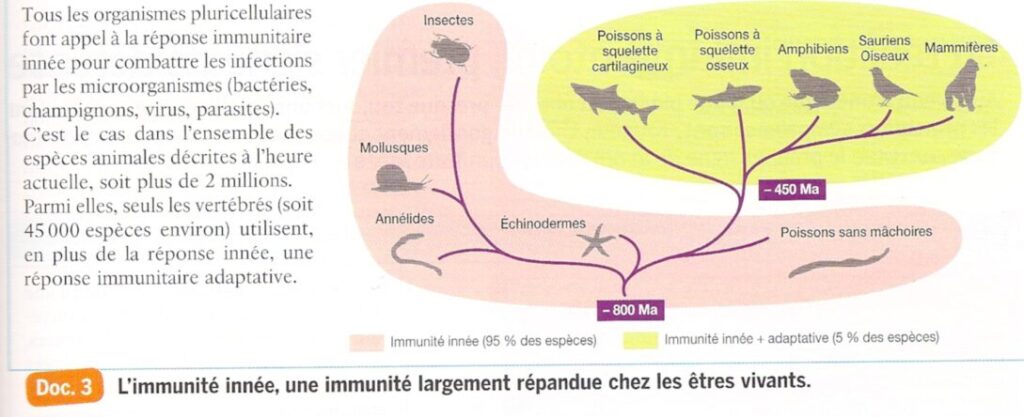
L’immunité adaptative complète l’immunité innée chez les vertébrés uniquement. Elle apparaît il y a 450 Ma.
B) Spécificité et délai
Elle assure une reconnaissance spécifique de certains motifs moléculaires (antigènes) portés par des agents infectieux ou des cellules anormales (cellules infectées par un virus, cellules cancéreuses, cellules lésées,…). L’immunité adaptative, contrairement à l’immunité innée, ne reconnaît pas des motifs partagés par de nombreux pathogènes (ex : molécule de la paroi bactérienne présente chez de nombreuses espèces bactériennes) mais des motifs moléculaires particuliers propres au pathogène (ex : un fragment de molécule spécifique d’une espèce de bactérie).
Du fait de cette spécificité, elle est plus longue à se mettre en place et à intervenir que la réaction innée. Elle est déclenchée lorsque l’immunité innée ne suffit pas à venir à bout de l’agent pathogène. Associée à l’immunité innée qui se poursuit, elle réussit le plus souvent à éliminer la cause du déclenchement de la réaction immunitaire.
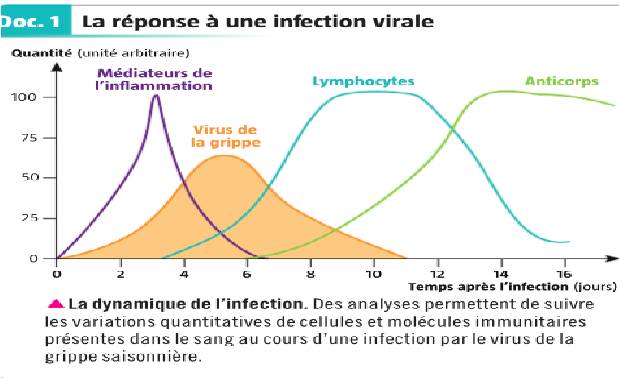
C) La coopération cellulaire
Les lymphocytes sont des cellules de l’immunité adaptative qui coopèrent ensemble pour éliminer les pathogènes grâce à des molécules qui sont des récepteurs membranaires ou des molécules messagères (interleukines,…) :
- les lymphocytes T CD4+ qui se différencieront en lymphocytes T helpers ou auxiliaires. Ils reconnaissent les antigènes présentés par les CPA grâce à leurs récepteurs membranaires T CD4 (et sécrètent des molécules messagères (interleukines) pour activer les autres cellules de l’immunité adaptative. Ils interviennent systématiquement dans l’immunité adaptative.
- les lymphocytes T CD8+, qui se différencieront en lymphocytes T tueurs ou cytotoxiques. Ils reconnaissent les cellules anormales (infectées ou cancéreuses) grâce à leurs récepteurs membranaires T CD8 et les détruisent. C’est l’immunité adaptative à médiation cellulaire qui élimine spécifiquement les cellules modifiées par un pathogène qu’elles hébergent (ex : virus) ou par un cancer.
- les lymphocytes B qui reconnaissent les antigènes présentés par les CPA grâce à leurs anticorps = immunoglobulines, des récepteurs présents à leur surface. Ils se différencient alors en plasmocytes, qui sécrètent des anticorps dans le sang qui reconnaissent et neutralisent les agents pathogènes circulants, avant qu’ils soient phagocytés par des phagocytes. C’est l’immunité adaptative à médiation humorale (humeur = sang), qui élimine spécifiquement les pathogènes circulant dans le sang et la lymphe (ex : bactéries, toxines, spores de champignons, quelques virus circulants…).

II. La spécificité et la variabilité des récepteurs (TP3)
La spécificité de la réponse adaptative aux différents antigènes nécessite une grande variabilité des récepteurs de l’immunité adaptative : en effet, il existe une grande diversité d’agents pathogènes, qui évoluent constamment par mutation. On cherche à expliquer les mécanismes qui permettent cette spécificité dirigée uniquement contre les agents pathogènes.
A) La structure des récepteurs
Les récepteurs des lymphocytes B et T sont des protéines membranaires. Ils comportent plusieurs chaines, avec :
- une région constante, dont une partie est insérée dans la membrane plasmique de la cellule
- une (chez les LT) ou deux (chez les LB) régions variables qui reconnaissent et se fixent à l’antigène. La variabilité de cette région permet de reconnaître la grande diversité des antigènes des différents pathogènes.
Les récepteurs des LB sont appelés immunoglobulines ou anticorps.
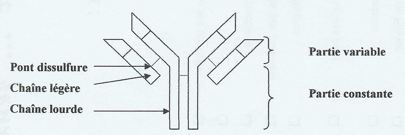
B) La variabilité des récepteurs
Le nombre de gènes qu’il faudrait en théorie pour coder la diversité des récepteurs des lymphocytes dépasse le génome humain. Il existe donc des mécanismes génétiques permettant de générer cette diversité lors de la formation des cellules immunitaires.
Les lymphocytes B se forment dans les organes lymphoïdes primaires (moelle osseuse pour les lymphocytes B, thymus pour les lymphocytes T) par divisions cellulaires à partir d’une cellule souche. Lors de leur formation, des mécanismes de recombinaison génétique engendrent des combinatoires immenses de gènes. Ces gènes recombinés codent chacun une protéine composite spécifique d’un lymphocyte donné, ce qui est à l’origine de la grande diversité des récepteurs des lymphocytes, comme les anticorps, par :
- recombinaison de segments de gènes exprimant les parties constantes et variables des chaînes lourdes et légères
- assemblage des chaînes lourdes et légères après expression de ces gènes (ARNm et synthèse de protéines) formant ainsi les immunoglobulines ;
- un épissage interviendrait aussi, augmentant encore la diversité des anticorps produits
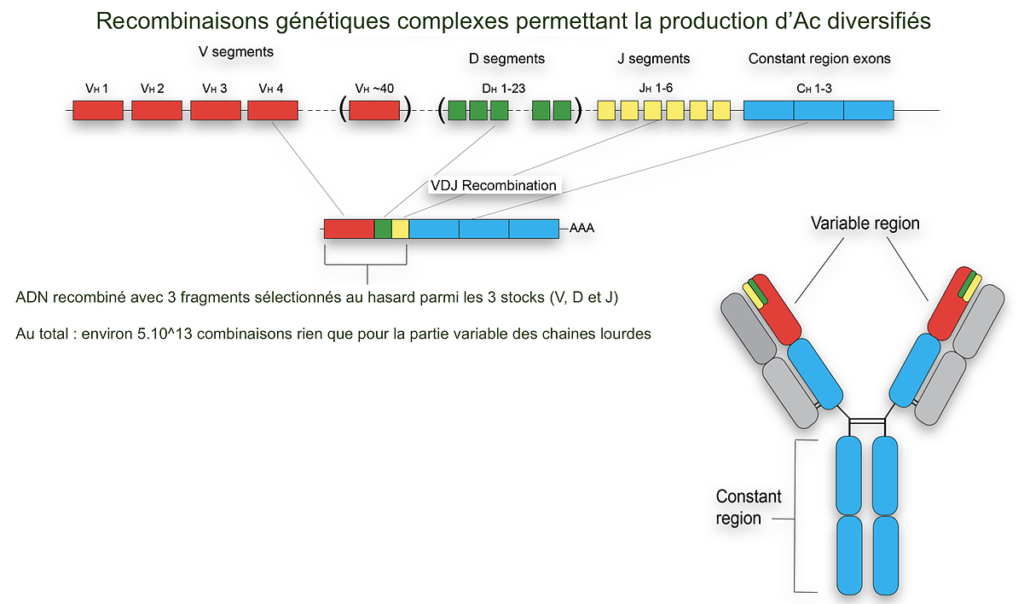
A l’issue de ce processus, chaque lymphocyte B naïf a ainsi une combinaison unique de segments de gène pour la chaine lourde et la chaine légère de ses immunoglobulines, et donc des immunoglobulines (toutes identiques) qui lui sont propres. La diversité des lymphocytes B naïfs produits tout au long de la vie d’un individu constitue son répertoire immunitaire. Des mécanismes similaires permettent la même diversité des récepteurs T. Ces mécanismes aléatoires engendrent une diversité telle que tous les antigènes possibles sont en principe reconnaissables.
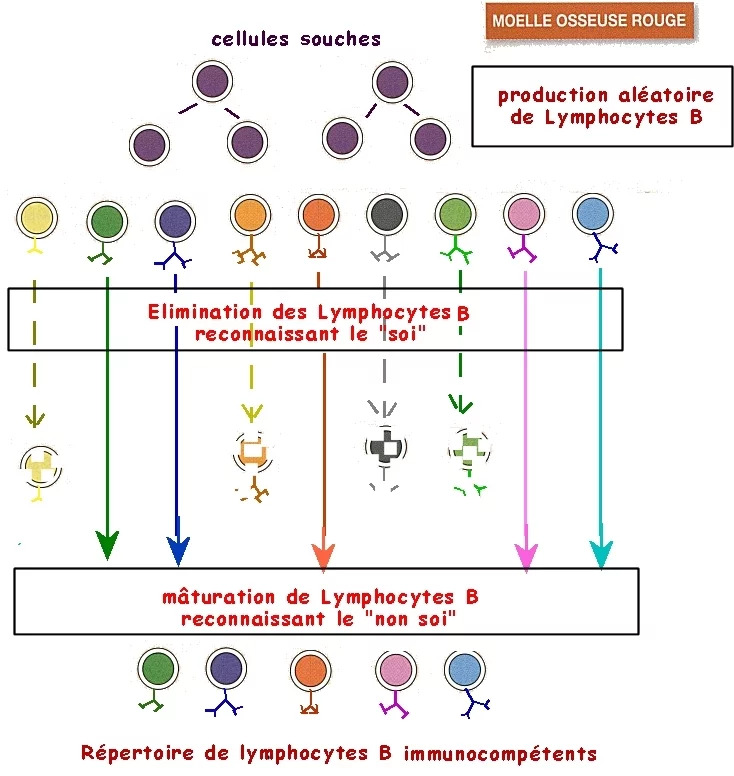
C) La sélection des récepteurs
Ensuite, deux sélections se produisent :
- Les lymphocytes autoréactifs (qui réagissent aux molécules de l’organisme ou de ses symbiotes) sont éliminés car ils sont incompatibles avec le soi. En effet, un dérèglement de ce processus d’élimination peut conduire aux maladies auto-immunes (ex : sclérose en plaques,…). Ainsi, la réponse immunitaire ne se déclenche normalement pas contre des molécules de l’organisme ou de ses symbiotes.
- Les lymphocytes permettant de lutter contre le pathogène sont sélectionnés. En effet, les cellules de l’immunité adaptative ne deviennent effectrices qu’après une première rencontre avec un antigène grâce aux phénomènes :
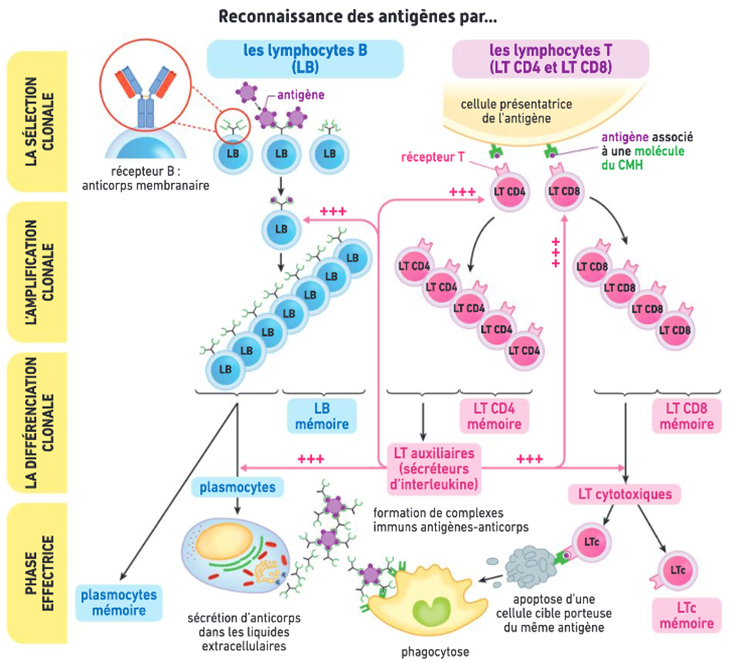
- de sélection clonale des lymphocytes naïfs (= n’ayant jamais rencontré d’antigène) qui présentent des récepteurs capables de se lier à l’antigène
- d’amplification clonale : les lymphocytes B, T CD4 et T CD8 sélectionnés se multiplient activement par mitoses successives et forment un clone sous l’effet notamment de l’interleukine 2 ; les lymphocytes capables de reconnaître l’antigène se multiplient ainsi en grand nombre, portant tous les même récepteurs, et formant ainsi un clone. Ils sont à même de reconnaître les agents pathogènes présents dans l’organisme.
- et de différenciation clonales : les cellules se spécialisent et deviennent actives : notamment, les lymphocytes B se différencient en plasmocytes capables de sécréter beaucoup d’anticorps.
La réponse immunitaire adaptative à un pathogène résulte donc de la production de nombreuses cellules immunitaires naïves avec des récepteurs différents et de la sélection des cellules efficaces pour lutter contre ce pathogène.

III. L’élimination du pathogène
A) L’activation des lymphocytes
Lorsqu’une CPA migre dans un organe lymphoïde secondaire (ganglions lymphatiques, amygdales, rate), elle présente l’antigène à tous les lymphocytes T naïfs. Les lymphocytes T (CD4 ou CD8) ayant un récepteur possédant une forte affinité à l’antigène (liaison forte entre le récepteur et l’antigène) forment un complexe (association moléculaire) stable avec la CPA qui leur envoie alors un message chimique. Les lymphocytes T CD4+ sont alors activés s’il y a des signaux extérieurs d’agents pathogènes (pour éviter une maladie auto-immune si un lymphocyte auto-réactifs n’ont pas été éliminés). Ils se différencient en LT auxiliaires ou helpers (LTa) qui secrètent des molécules chimiques de communication cellulaire, notamment les interleukines, les cytokines, qui activent les autres lymphocytes et favorisent leur prolifération par exemple grâce à l’interleukine 2 qui est mitogène (provoque la mitose des cellules). Ils activent ainsi :
- Les lymphocytes T CD8+ dont le récepteur est lié à un antigène présenté par le CMH d’une CPA (remarque : les lymphocytes T ne peuvent reconnaître l’antigène libre)
- Les lymphocytes B dont le récepteur est lié à un antigène libre
Une fois activés, ces lymphocytes sélectionnés (sélection clonale) se multiplient (amplification clonale), puis se différencient (différenciation clonale), devenant alors prêts à neutraliser ou éliminer l’agent pathogène: ils sont efficients. Les LT CD4+ ont donc un rôle central d’activation des autres lymphocytes et donc de la réaction adaptative en général.
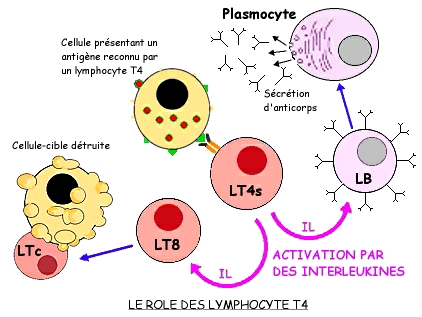
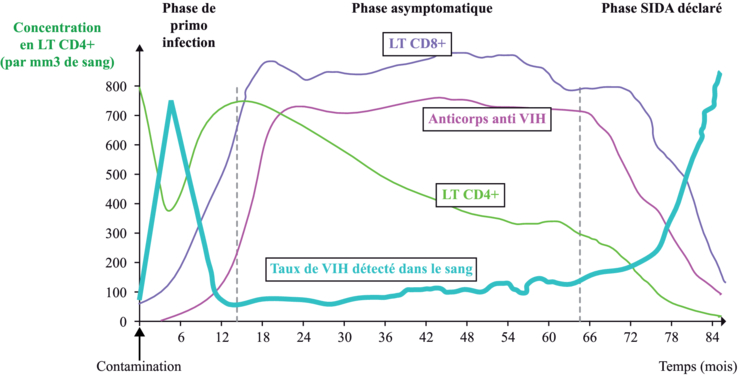
Ce rôle central d’activation et d’amplification de la réponse immunitaire adaptative par les LT CD4+ est souligné dans le cas du SIDA : l’immunodéficience (acquise) est due à un faible taux de LT CD4+, qui ne permet pas de bonnes défenses pour l’immunité adaptative chez les patients atteints, ce qui les empêche d’avoir de bonnes défenses contre les infections.
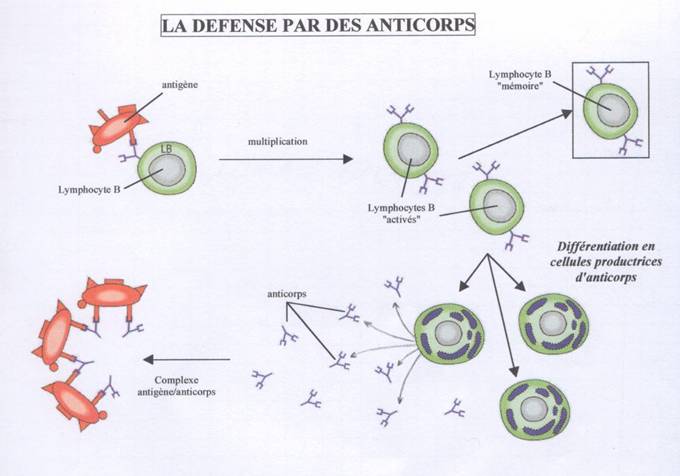
B) L’immunité adaptative humorale et les LB
Les lymphocytes B activés et multipliés se différencient en plasmocytes : leur noyau grossit, l’expression génétique est forte pour produite un grand nombre d’anticorps (= immunoglobulines) qu’ils libèrent dans le sang.
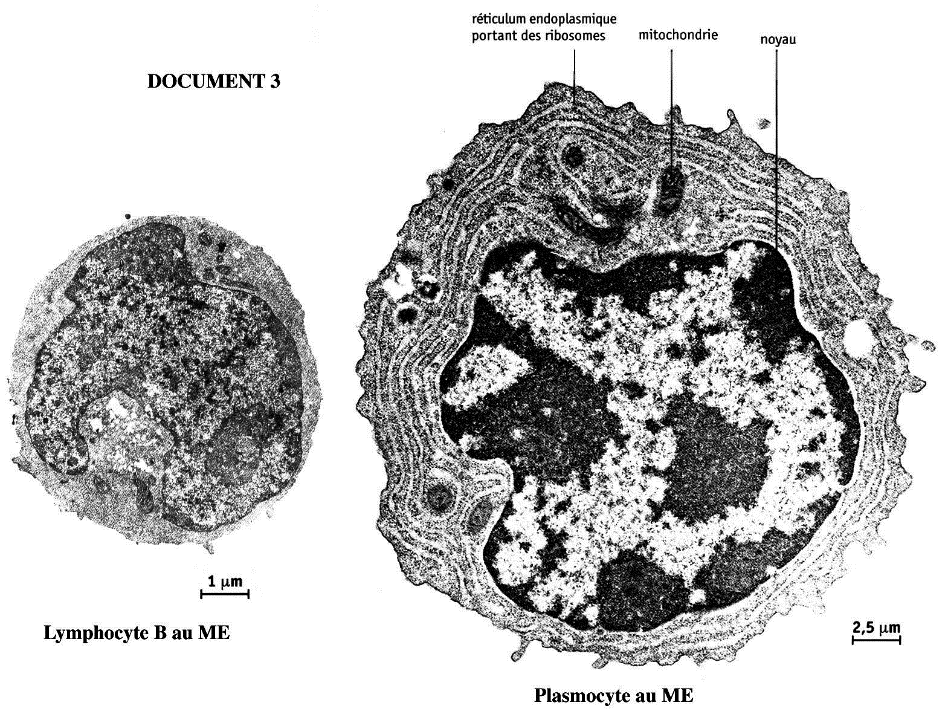
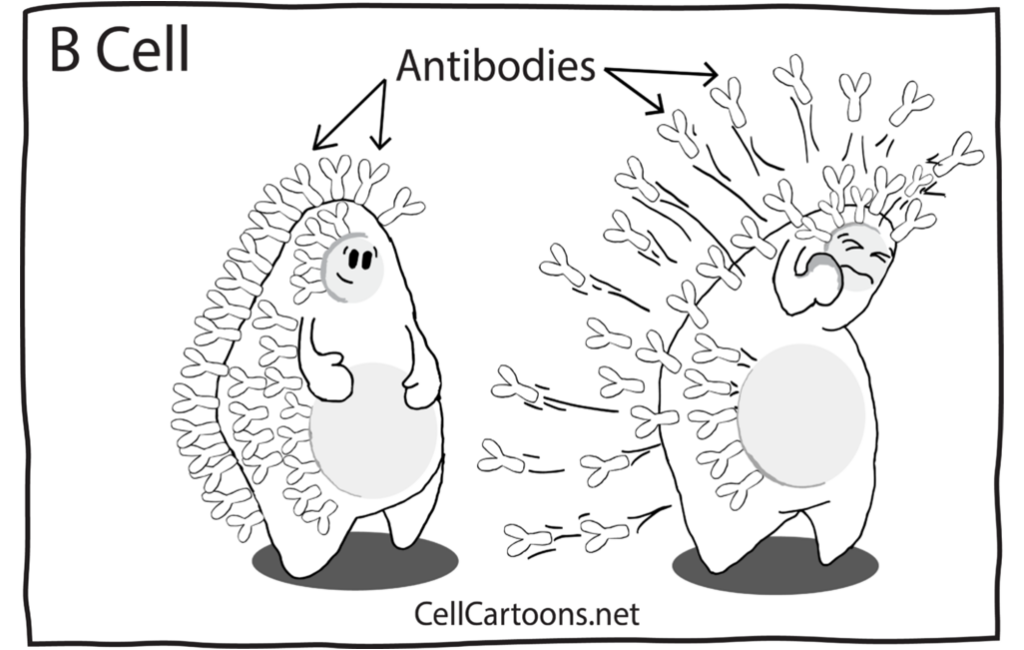
Les immunoglobulines se fixent aux pathogènes circulant dans le sang par l’antigène qu’elles reconnaissent, les agglomèrent entre eux, et forment ainsi des complexes immuns qui neutralisent les pathogènes et les empêchent d’entrer dans de nouvelles cellules.
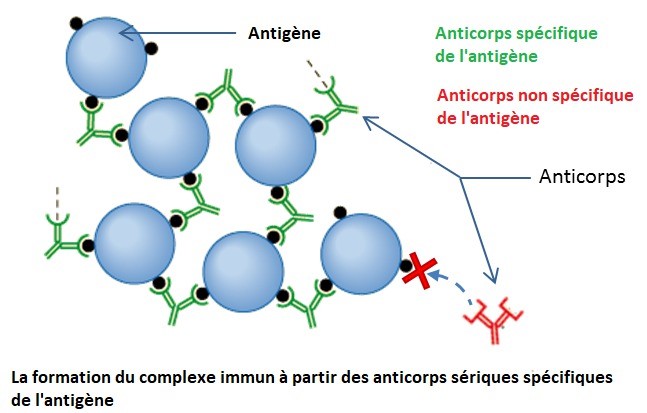
Cependant, les anticorps seuls n’éliminent pas le pathogène : les cellules phagocytaires de l’immunité innée ont des récepteurs aux domaines constants des immunoglobulines. Elles phagocytent les complexes immuns, ce qui élimine les pathogènes: il y a donc ici une coopération entre l’immunité innée et l’immunité adaptative. Les lymphocytes B activés ont aussi un rôle de phagocytes et de cellule présentatrice d’antigène (CPA).
Les lymphocyte B sont donc responsables de l’immunité adaptative humorale (humeur = sang). Lorsque des anticorps spécifiques d’un antigène sont présents dans le sérum (sang débarrassé des cellules et des protéines de coagulation), on observe une réaction positive lors d’un test immunologique (test d’Ouchterlony, électrophorèse,…) : le patient est séropositif pour cet antigène.
C) L’immunité adaptative cellulaire et les LT CD8+
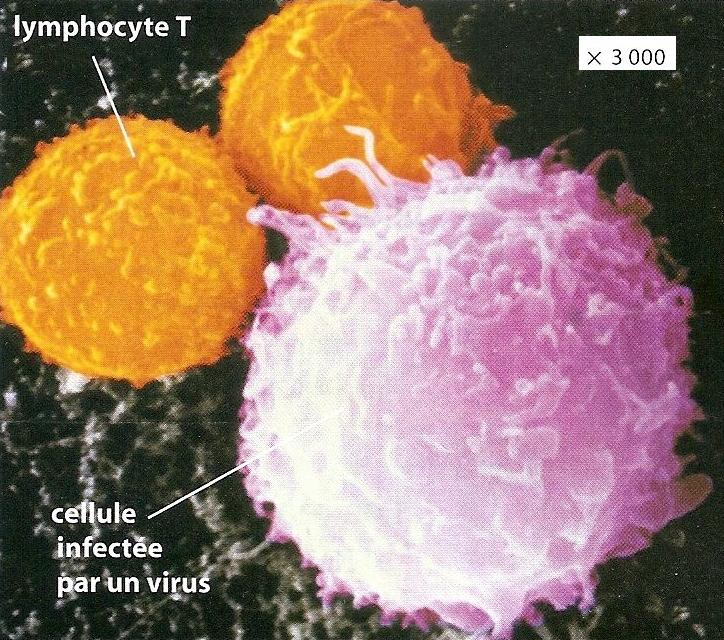
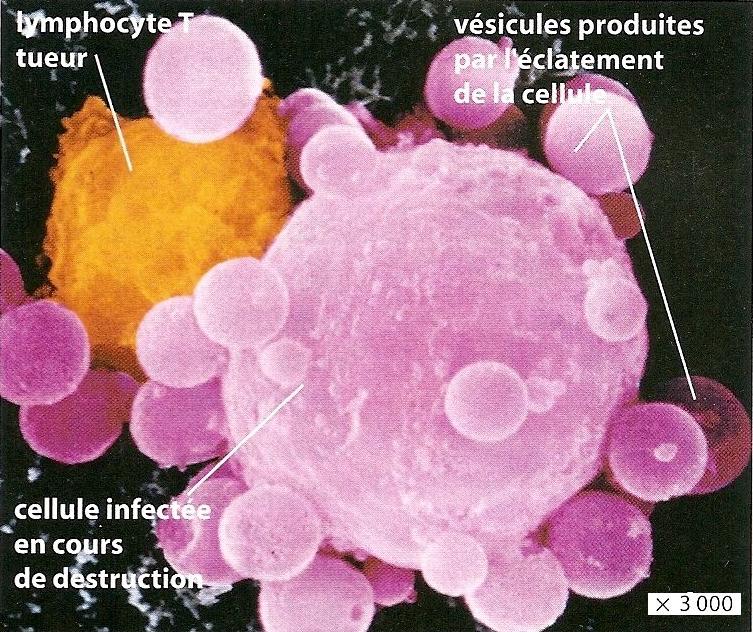
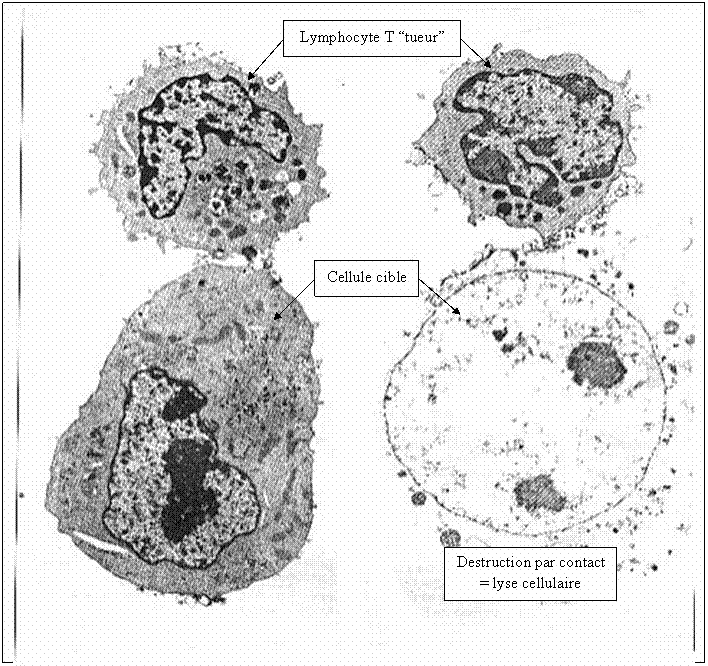
Les lymphocytes T CD8+ activés et multipliés se différencient en LT cytotoxiques LTc = LT tueurs qui contiennent des granules lytiques. Ils se déplacent alors dans l’organisme jusqu’à reconnaitre une cellule altérée de l’organisme (« soi modifié« , par un virus ou une tumeur par exemple) qui présente l’antigène reconnu par leur récepteur. Ils la détruisent en sécrétant les composés contenus dans leurs granules lytiques dans la cellule altérée, ce qui provoque sa lyse (= destruction) cellulaire par apoptose (= mort de la cellule). Les LTc sont responsables de l’immunité à médiation cellulaire car ils éliminent les cellules altérées par contact. La lyse cellulaire libère peu de déchets qui sont ensuite éliminés par phagocytose par les cellules de l’immunité innée.

IV. La surveillance immunitaire
A) La mémoire immunitaire
Lors de la prolifération clonale et pendant toute la durée de la réaction immunitaire suite à une première infection, l’immunité adaptative met en place des cellules mémoire à longue durée de vie issues de la différenciation des lymphocytes. Ces cellules permettent une réponse secondaire à l’antigène plus rapide et quantitativement plus importante qui assure une protection de l’organisme vis-à-vis de cet antigène. C’est le fondement de la vaccination (voir chapitre 3).
B) Le système immunitaire dans l’organisme
Le système immunitaire dans son ensemble (inné et acquis) est composé d’éléments dispersés (organes, cellules, molécules: voir chapitre d’introduction) : il est diffus dans l’organisme. Il interagit avec les différentes parties du corps (cerveau, intestins, etc.) pour contribuer à notre santé.
Conclusion
Les défenses adaptatives associées aux défenses innées permettent normalement d’éliminer la cause du déclenchement de la réaction immunitaire. L’immunité adaptative nécessite un apprentissage des lymphocytes au cours du processus de maturation. Le délai d’intervention de l’immunité adaptative est dû à une sélection, multiplication et différenciation clonales. Elle est aussi le siège de la mémoire immunitaire, ce qui permet d’acquérir une immunité spécifique à long terme contre certains pathogènes. Elle est utilisée médicalement à ce titre.